Retornar para: Colunas - Como Funciona
06/06/2005
< Como funciona o LASER >
I – Moléculas e átomos
Nas colunas passadas mencionamos que a leitura dos dados nos dispositivos de armazenamento ótico é feita com o emprego de um raio laser. Mas o que é um laser? De onde vem esse nome? Como funciona?
Laser e um dispositivo que se aproveita do efeito da mecânica quântica denominado "emissão estimulada" para gerar um feixe de luz coerente em um meio cuja forma, dimensões e pureza são cuidadosamente controladas. Seu nome, LASER, é o acrônimo de " Light Amplification by Stimulated Emission of Radiation" ou "amplificação da luz por emissão estimulada de radiação". Parece complicado? Então vamos destrinchar.
A mecânica é o ramo da física que estuda os corpos no que diz respeito à sua massa, seus movimentos e efeitos das forças a eles aplicadas. A mecânica que estudamos no colégio é a "mecânica Newtoniana", baseada nas leis de Newton. Seus conceitos funcionam perfeitamente quando aplicados aos corpos de grande massa. Porém não conseguem explicar os mesmos fenômenos em corpos na escala de moléculas, átomos e seus constituintes, as partículas atômicas. É aí que entra a mecânica quântica, o ramo da física que lida com partículas em escala extraordinariamente reduzida, um universo composto por moléculas, átomos, as partículas que os formam, seus movimentos e as forças que agem sobre elas. A coisa parece (e é) um tanto complicada, mas nada nos impede de simplificar.
Então vamos tentar abordar alguns fenômenos da mecânica quântica da forma mais elementar possível para facilitar o entendimento. Mesmo porque é impossível discutir como funciona o laser sem abordar alguns tópicos desse campo da física pois, como vimos na própria definição de laser, ele deriva de um efeito que se baseia na emissão estimulada de energia pelos átomos, um fenômeno da mecânica quântica. Mas não se preocupe que o diabo (e a mecânica quântica) não são tão feios quanto os pintam.
Primeiro, vamos avivar os conceitos de moléculas e átomos.
Todas as substâncias conhecidas, sólidas, líquidas e gasosas, são formadas por moléculas. E toda molécula é formada por átomos.
A palavra "átomo" significa "indivisível". Quando se começou a estudar a natureza da matéria, constatou-se que se poderia dividir (decompor) uma molécula nos átomos que a formam, mas não descobriram como dividir um átomo. Por isso imaginaram que ele seria a menor partícula possível de matéria e lhe deram esse nome. Mais tarde foram descobertas as partículas subatômicas, ou seja, os componentes dos átomos, provando que eles poderiam ser divididos, mas nessa altura dos acontecimentos o nome já tinha "pegado" e ficou átomo mesmo.
Há pouco mais de cem diferentes átomos no universo conhecido. Cada um deles identifica um "elemento químico". Agrupados segundo suas características físicoquímicas, formam a "Tabela periódica dos elementos". Se você quiser ter uma idéia da aparência desta tabela e de algumas das propriedades dos átomos que a formam, visite o sítio do Centro de Divulgação Científica e Cultural da Universidade de São Paulo – CDCC/USP e veja uma tabela periódica em < desculpe, esta página foi removida da internet; ver OBS adiante >. Mova o mouse sobre os símbolos dos elementos na tabela e veja, na parte superior, o nome do elemento, seu descobridor, seu ponto de fusão e ebulição e outras características. Dentre elas, repare o número de elétrons nas camadas. Pouse o cursor sobre o símbolo do alumínio, Al, e perceba que a caixa "Elétrons nas Camadas" mostra os números " 2", " 8" e " 3" separados por vírgulas. O que isto significa?
OBS: a página apontada pelo texto original foi removida. Porém, na ocasião em que foi feita esta revisão (março de 2021) uma página semelhante pode ser encontrada no portal Ptable
Bem, acho que você recorda que a representação clássica do átomo lembra a do sistema solar. No centro, no lugar do sol, há o núcleo, constituído por partículas pesadas, prótons (com cargas elétricas positivas) e nêutrons (sem cargas elétricas). E, girando em torno do núcleo como os planetas giram em torno do sol, a chamada "coroa de elétrons", formada por elétrons, partículas mais leves e com carga elétrica negativa, cada uma se movimentando em sua órbita.
Um átomo se distingue de outro pelo número de prótons e nêutrons no núcleo (o número de elétrons deve ser igual ao de prótons para manter a carga elétrica do átomo em equilíbrio).
O núcleo do átomo do alumínio é formado por 27 partículas atômicas: 14 nêutrons e 13 prótons. Portanto sua "coroa de elétrons" deve ser formada por exatamente 13 elétrons (cujas cargas negativas compensam as cargas positivas dos 13 prótons). E 13 é justamente a soma de 2 + 8 + 3 = 13, os "elétrons nas camadas".
Mas que camadas são essas?
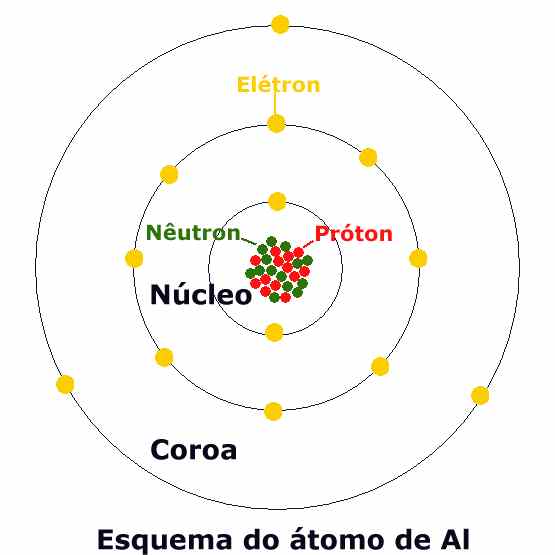
FIGURA 1 – Esquema bidimensional do átomo de Alumínio
Ocorre que, diferentemente do que acontece no sistema solar, onde cada planeta gira em uma órbita em diferentes distâncias do sol, os elétrons que orbitam o núcleo dos átomos situam-se em camadas. Isso significa que há um conjunto de elétrons orbitando perto do núcleo (em trajetórias diferentes, mas todas à mesma distância do núcleo), um segundo conjunto orbitando um pouco mais longe e assim por diante, como se as órbitas de cada um desses conjuntos formassem uma camada. Pode haver até sete camadas de elétrons em torno do núcleo, cada uma suportando um número máximo de elétrons (2, 8, 18, 32, 32, 18 e 8, respectivamente, da camada mais interna para a mais externa). Em condições de equilíbrio, as camadas mais internas estão sempre com seu número máximo de elétrons, enquanto a última pode abrigar um número menor que o máximo. O átomo de alumínio, por exemplo, tem três camadas de elétrons, dois girando na camada mais interna, oito um pouco mais afastados e apenas três na camada mais externa, no caso a terceira. Seu aspecto esquemático é mostrado na Figura 1. Mas este esquema bidimensional serve apenas para dar uma idéia do conceito de "camadas". Uma representação tridimensional do mesmo átomo seria a mostrada na Animação 1, onde se pode perceber claramente o núcleo e, com algum esforço, treze elétrons orbitando em torno dele, distribuídos nas três camadas.
A mais externa, mais fácil de distinguir, é formada por apenas três elétrons.
ANIMAÇÃO 1 – Esquema tridimensional do átomo de alumínio
Mesmo em um corpo aparentemente imóvel, os átomos estão em constante movimento. E esse movimento não se limita à translação dos elétrons em suas órbitas. Os próprios átomos vibram, movem-se, giram. Esse movimento reflete o estado de energia da matéria. Quando um corpo "esquenta" ao se lhe fornecer calor, ele acumula energia (térmica) e isso aumenta o estado de excitação de seus átomos. Há diversas formas de fornecer energia aos corpos (e a seus átomos), mas as mais comuns são através do calor (energia térmica), luz (energia luminosa) e eletricidade (energia elétrica).
O "estado de excitação" dos átomos reflete o nível de energia acumulado pela matéria. E uma das formas da matéria acumular energia é deslocando os elétrons de suas órbitas. Isso ocorre porque cada "camada" onde os elétrons orbitam corresponde a um nível de energia. As camadas mais internas correspondem a níveis energéticos menores que as mais externas.
Pronto. Se você conseguiu acompanhar a coisa até este ponto e entendeu os conceitos fundamentais, já passou pelo trecho mais pedregoso da caminhada.
Porque daqui para a frente tudo é mais simples e os conceitos são mais fáceis de entender.
Como vocês verão na próxima coluna.


